La physique quantique et le bashing de chimiste vous ont manqué depuis la dernière fois ? Non ?! Tant pis, on reprend quand même !
On était arrivé au point où on avait des électrons quantiques sur des orbites superbement numérotées avec impossibilité totale pour l’électron d’être entre les orbites. Et on se demandait justement si le fait d’avoir juste des orbites numérotées avec nombres entiers ça serait un peut pas révolutionnaire du tout… dans le système solaire aussi je peux numéroter les orbites des neuf huit planètes !
Sauf que c’est pas pareil ! Car, en effet, des orbites quantiques C’EST révolutionnaire et que le modèle “système solaire” était tout naze.
Dessine-moi un mouton nuage électronique
Déjà, il y avait un indice comme quoi c’était foireux : dans le système solaire, toutes les s sont grosso modo dans le même plan… or ça ce n’est pas possible pour les atomes, car sinon ils auraient un “sens” privilégié… ils ne seraient pas ronds quoi ! Or les atomes plats… nan ça fait longtemps qu’on sait qu’ils sont globalement “ronds”.
Donc on a commencé à faire des jolis calculs pour voir ce que ça donnait des électrons quantiques autour d’un noyau… Eh ben, on a pas été déçu parce que… bah c’est chelou…
Attention petit lycéen qui serait arrivé ici pour comprendre ton cours de chimie… là je vais partir dans des trucs très très hors de ton programme. Vraiment. Mais c’est cool, tu peux rester.
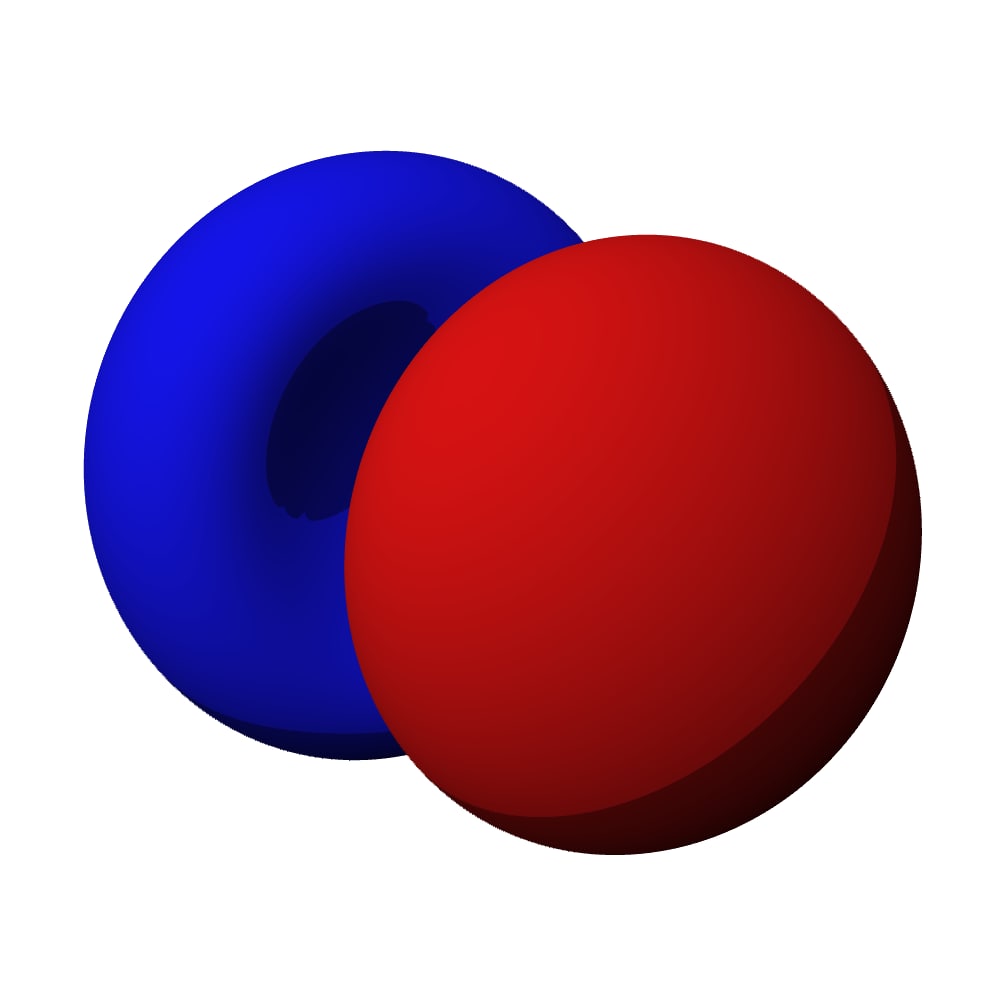
Couche 1 : Bouboule or not bouboule ?
Par exemple, la couche 1, c’est… une boule… pas un disque ou même une sphère creuse… nan une grosse bouboule.


Mais alors l’électron il tourne dans la boule ?

Alors les électrons (comme tous les machins quantiques) il faut plus les voir comme un truc gazeux… l’électron est “flou”, il n’est pas à un endroit particulier…
🤔 Mais alors on ne peut pas vraiment dire “où” il est ?
Tout ce qu’on peut dire en vrai sur un électron, c’est où il est probable qu’il soit. Si vous le voyez comme un gaz, là où il est très probable le gaz est dense et là où il est très peu probable le gaz est super ténu.
Et là, vous croyez que c’est bizarre ? Non, non, non, mon petite chérie ! Maintenant, on attaque le bizarre !
Si jamais vous essayez de regarder votre électron (par exemple en mesurant sa position avec un appareil de mesure) là il va faire son timide et arrêter de faire mumuse à être un gaz chelou : il va apparaitre comme une belle particule avec une belle position bien précise.

Genre, il “sait qu’on le regarde” ? Disons qu’il réagit au fait qu’on le regarde…
Donc, pendant que personne ne le regarde, il fait ça petite vie d’électron qui ressemble à un nuage chelou… mais dès qu’on essaye de le regarder : paf il redevient un électron tout “dur” avec un rayon, une position et tout.
C’est un peu comme ces persos en fantasy (souvent des fantômes ou des magiciens) qui dès qu’on essaye de taper dessus se transforment en gaz et dès qu’on a fini de taper redeviennent solide.
Alors, comment on fait pour représenter un merdier pareil 😳 ?
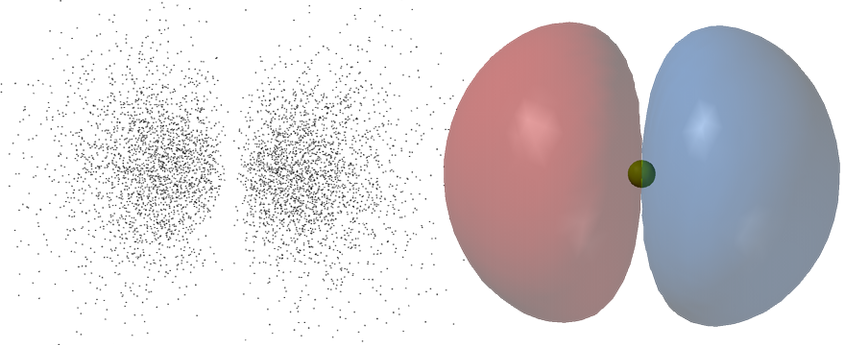
On ne va pas se mentir, c’est pas facile de représenter un machin gazeux intangible… le mieux qu’on puisse faire c’est représenter la forme de la zone où il est TRÈS PROBABLE que l’électron se trouve (et comme il se déplace très vite là-dedans on sait qu’en fait ça va être là qu’il se trouve “en gros”).

👆 À droite, la forme en 3d autour du noyau et à gauche une représentation de la probabilité de présence de l’électron : on voit que, en fait, l’électron est plus probable proche du noyau (les points sont plus denses)
Donc c’est tout ? On a juste des électrons gazeux qui se comportent comme des fantômes et qui flippent qu’on les voit ? Bon bah… ça va… au lieu de penser à des orbites plates comme celle des planètes on va penser à des bouboules et puis ça sera bon…

C’est-à-dire que là on a vu la couche 1… qui est une bouboule… dès que n = 2 ça devient funky…
Bon déjà combien on peut mettre d’électrons dans la couche 1 avant de passer aux étages d’au-dessus ?
2 électrons ! Pourquoi ?

En théorie il est impossible en physique quantique d’avoir 2 particules de matière exactement au même endroit (genre, on ne peut pas mettre Mlle Z. et sa sœur M. exactement au même endroit… l’espace est occupé par l’une ou par l’autre). C’est un peu ce qui définit le concept même de matière : on ne peut pas être au même endroit !
Et quand il s’agit de particules quantiques, c’est encore plus général : il est impossible qu’elles aient les mêmes états quantiques…
Donc 2 électrons ne peuvent pas avoir n=1 ???
Ben si… car on sait depuis assez longtemps que les électrons ont une autre caractéristique : le spin… c’est en gros la façon dont ils se comportent comme un aimant : soit ils ont le pôle nord vers le haut (up) soit ils ont le pôle nord vers le bas (down).
Ça se note s (comme spin) et les valeurs correspondantes sont +½ et -½… (oui des nombres quantiques qui ne tombent pas sur des nombres entiers c’est bizarre) et c’est des valeurs quantiques donc il n’y a aucune autre valeur possible. On les note souvent ↑ et ↓.
Donc notre couche 1 peut bien contenir 2 électrons :
\[ \left\{ \begin{array}{ll} n = 1 & s=\uparrow \\ n = 1 & s=\downarrow \end{array} \right. \]
Et ça colle bien avec les observations des chimistes : l’hélium qui a 2 électrons a bien une seule raie 2 fois plus brillante que celle de l’hydrogène qui a un seul électron (car il a 2 électrons pour émettre cette raie).
Et cette “règle du spin” sera toujours vraie : toutes les “orbitales” (nom qu’on a trouvé pour généraliser la vieille notion d’orbite… oui c’est un peu un nom pourri quand on sait que c’est pour remplacer le mot “orbite”)… toutes les orbitales donc peuvent contenir 2 électrons un up↑ et un down↓
C’est pour ça qu’on va voir plein de schémas où on représente des électrons par des flèches ↑ et ↓ !
Couche 2 : Quand les bouboules se mettent au LSD
OK, 2 électrons dans la couche 1… maintenant, j’en ajoute un 3e il n’y a plus de place en n=1 il va donc avoir n=2… mais ça ne change rien si ?
Bah, déjà ton électron est plus loin du noyau (c’est le principe des couches).

Et donc c’est une plus grosse bouboule #épicétou
…
…
…

Alors en partie oui : on a bien une orbitale bouboule plus grosse pour n=2… mais, elle n’est pas toute seule 😅
Les chimistes nous l’avaient dit en même temps : pour la deuxième couche, ils avaient vu plusieurs petites sous-raies toutes serrées. C’est à cause de ça qu’ils avaient tenté leur modèle de “sous-couches” électroniques en mode « On met plein d’électrons sur la même couche… mais, euh… enfin, tu vois c’est pas tout à fait la même couche ».
Donc les gugusses nous disent que cette couche 2 devait contenir normalement 8 électrons au max. Comme on a le droit de mettre 2 électrons par orbitales on devrait avoir donc 4 bouboules pour n=2 nan ?
Nan : on ne peut pas mettre plusieurs bouboules au même niveau d’énergie, elles seraient au même endroit…
Bah… on a qu’à les mettre les unes par-dessus les autres… genres des bouboules de plus en plus grosses, façon poupées russes, nan ?
Nan. Car alors on aurait des grosses différences d’énergie puisque les bouboules seraient de plus en plus loin du centre. Là, tous nos électrons sont au niveau n=2 qui a globalement la même énergie pour ses 8 électrons à quelques microdifférences près…1
Et c’est là qu’on va commencer à faire les foufous avec les nombres quantiques !
On va en rajouter un nombre quantique de plus pour décrire notre électron… bien obligé, car, impossible d’avoir des électrons dans les mêmes états quantiques. Et comme on continue à être hyper original on l’appelle “nombre quantique secondaire” et on va le noter ℓ.
Pour n=1 on va dire que ℓ=0 ce qui donne que nos premiers électrons maintenant c’est :
\[ \text{une bouboule à 2 électrons} \left\{ \begin{array}{lll} n = 1 & l = 0 & s = \uparrow \\ n = 1 & l = 0 & s = \downarrow \end{array} \right. \]
Et pour n=2 alors ? Là on va dire que ℓ peut valoir 0 ou 1 (c’est arbitraire à la couche d’avant on avait une seule valeur et ça suffisait à décrire la situation) :
\[ \begin{array}{ll} \text{une bouboule à 2 électrons} & \left\{ \begin{array}{lll} n = 2 & l = 0 & s = \uparrow \\ n = 2 & l = 0 & s = \downarrow \\ \end{array} \right. \\ \text{un machin avec 6 électrons} & \left\{ \begin{array}{lll} n = 2 & l = 1 & s = ??? \\ n = 2 & l = 1 & s = ??? \\ \end{array} \right. \end{array} \]
Euh… ça résout pas le problème : on a toujours 6 électrons dans notre deuxième machin… ce qui est impossible (il y aurait au moins 3 électrons n=2 ℓ=1 s=↑ et autant pour s=↓ ! (ne vous inquiétez pas on va y venir très vite)
Certes, mais le physicien aime bien quand les paramètres ont un sens physique… et ici ℓ sert à dire s’il y a une direction privilégiée :
- quand ℓ=0 👉 pas de direction privilégiée
- quand ℓ=1 👉 une direction particulière est pas traitée comme les autres
- quand ℓ=2 👉 deux directions particulières ne sont pas traitées comme les autres
- etc.
🤔 Aucune direction particulière : facile, ça décrit bien une bouboule !
🤔 Une direction particulière… ça pourrait être un cylindre par exemple : il a une direction ou il est tout droit et, dans les autres directions, c’est un cercle on ne peut pas savoir de quel côté on est.
…donc pour ℓ=1 on a pas une bouboule on a un cylindre ?

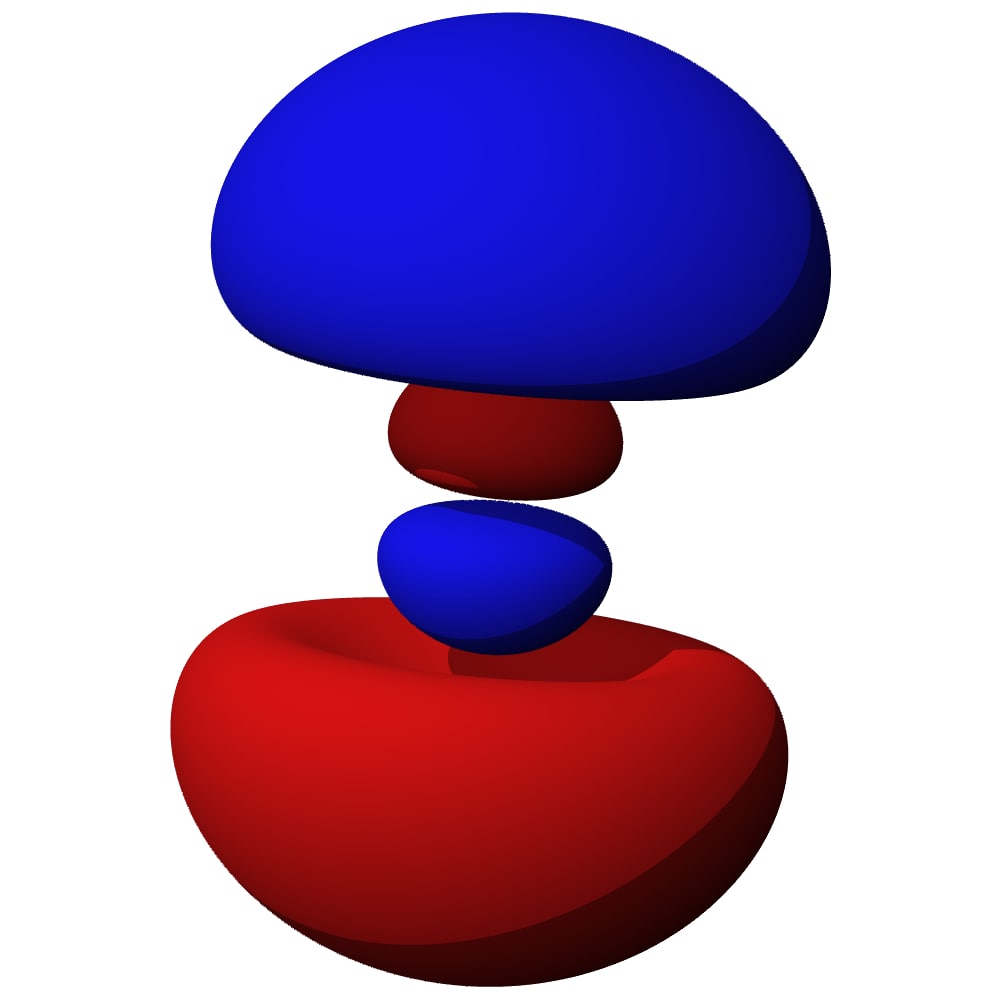
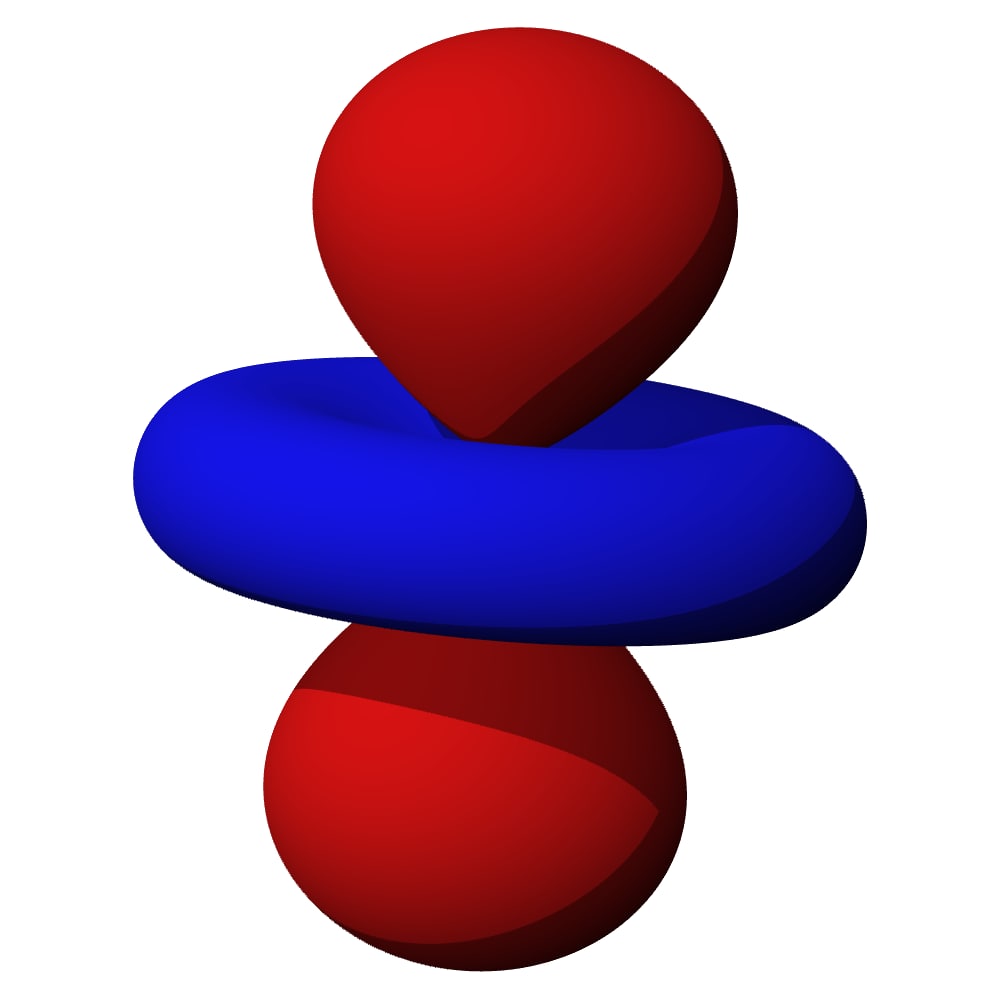
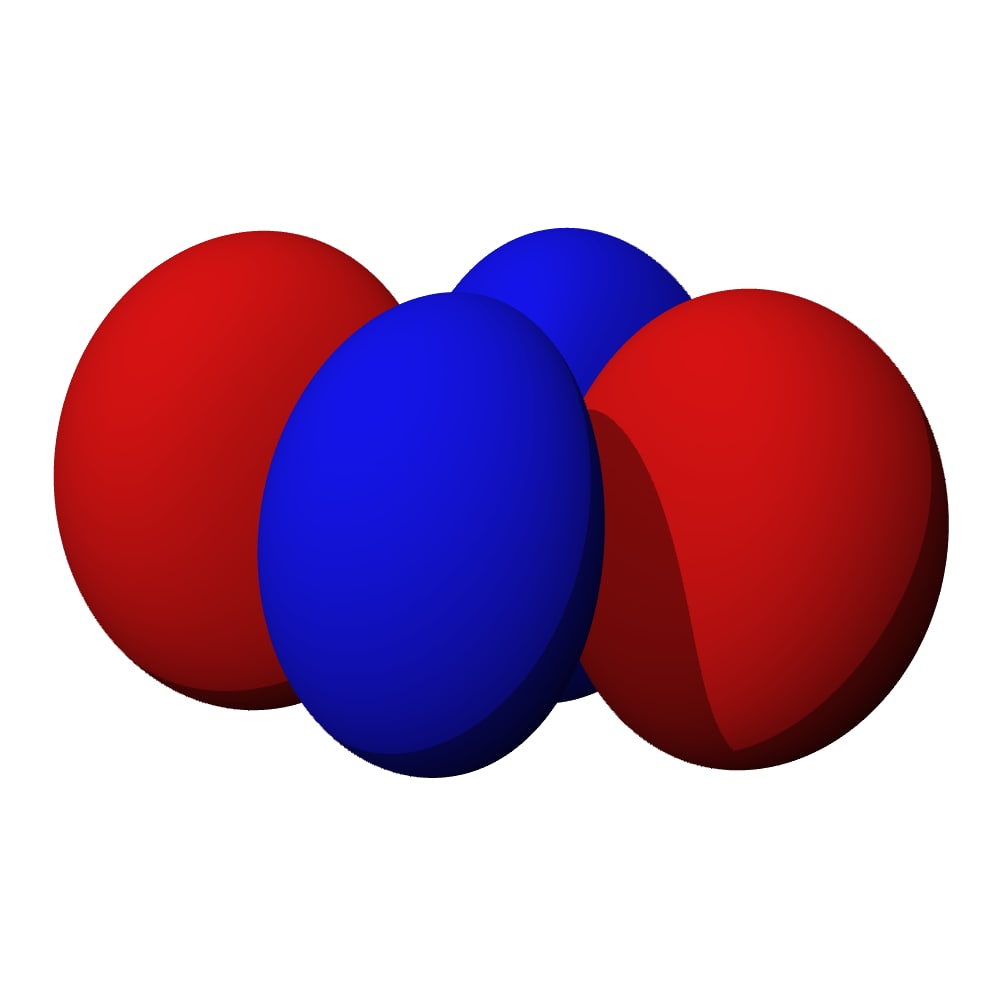
Le cylindre est un exemple de truc avec une direction privilégiée… mais la nature (enfin la résolution exacte des équations) a donné un résultat plus… original ! Jugez par vous-même. Behold the wonderful n=2, ℓ=1 :
On appelle ça une “altère”… c’est un genre de 8 en 3d. Et comme vous pouvez le voir sur le schéma de gauche : la probabilité est nulle au centre et assez élevée au milieu des 2 lobes.
Et il est toujours horizontal comme ça ? Justement non… on a dit qu’il devait y avoir un axe privilégié (ici horizontal), mais en fait il y a 3 cas possibles :

Soit l’altère est alignée sur l’axe vertical (z), soit sur l’axe de profondeur (y) soit on est aligné sur l’axe de largeur (x). Eh… mais donc, on a 3 orbitales différentes… en plus de la bouboule… soit 4 orbitales en tout. Et à deux électrons par orbitales ça fait 8 places 😱😱😱 Ça colle pile-poil aux observations des chimistes !!!!!!

Sauf que oui, mais non : ça ne résout pas notre problème… on a 6 électrons dans l’état n=2 ℓ=1 or on a droit à maximum 2 électrons dans cet état-là !!! Certes… mais on va résoudre ça facilement : il suffit de dire qu’on a un nombre quantique de plus qui dit quel axe on privilégie !
on va l’appeler mℓ ou “nombre quantique magnétique” et il aura 3 valeurs possibles : -1, 0 et +1 #magie

ON NE PEUT PAS S’AMUSER À CRÉER DES NOMBRES QUANTIQUES JUSTE PARCE QU’ON EN A BESOIN (on n’est pas des chimistes !!!)
Bon OK… déjà, dans les calculs on voit apparaitre ce quatrième nombre quantique assez rapidement (mais comme je ne vous ai fait aucun calcul ici, ce n’est clairement pas un bon argument), mais surtout ce nombre correspond au fait que l’orbitale va avoir un champ magnétique dans un sens ou un autre… or les mesures montrent que les atomes concernés ont effectivement un champ magnétique (très léger) quand ils ont des électrons dans ces orbitales-là.
Mais pour quoi -1, 0 et 1 ? Alors là c’est purement pour faciliter les notations. Ça correspond à trois états, il fallait les numéroter2. Et nos amis les chimistes sont contents : on colle incroyablement bien à tout ce qu’ils ont mesuré jusqu’ici.
Et si on leur donnait un nom ? (mais genre plein…)
D’ailleurs, les chimistes, ils trouvent que “bouboule” et “altère” ça fait pas très scientifique… et, justement, ils avaient déjà trouvé des noms pour ces machins-là (en fait eux ils avaient des noms pour les raies qu’il avait observés…) :
bouboulenon, non, non 👉 sharp (parce que c’était bien net comme raie) 👉 on notera “s”haltèrenon, non, non 👉 principal (parce que c’est les principales sous-raies visibles) 👉 on notera “p”
Ils en ont même pour après :
- diffuse (parce qu’on commence à vraiment pas les voir ces putains de raies) 👉 on notera “d”
- fundamental (parce que celles-là on aimerait les voir, genre théoriquement elles devraient être là, mais en vraie tu en chies pour avoir une preuve qu’elles existent) 👉 on notera “f”
On parle donc d’orbitales 1s (la bouboule de niveau 1) puis 2s (la bouboule de niveau 2) et 2p (les haltères de niveau 2) et comme il y en a 3 on les appelle 2px, 2py et 2pz (une sur chaque axe).
Et pour montrer où sont nos électrons, on a deux façons de les représenter facilement :
1️⃣ on fait des petites cases dans lesquelles on met les électrons sous forme de flèches :
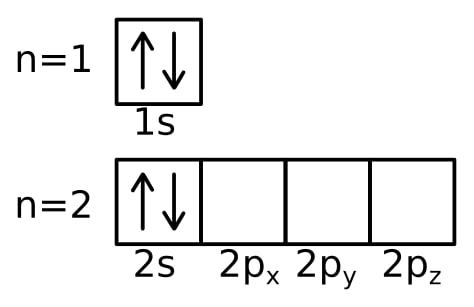
Mais bon, c’est un peu long de noter comme ça…
2️⃣ on se contente de noter le nombre d’électrons sur chaque orbitale (en regroupant les orbitales de même mℓ… donc sans séparer 2px 2py et 2pz). Ce qui donne pour le béryllium vu au-dessus :
Be : 1s² 2s²
Ou pour un atome à 10 électrons (le néon) :
Ne : 1s² 2s² 2p⁶

Règles à retenir
Après je pourrais continuer à te faire le niveau 3 puis 4… mais, ça ne servirait pas à grand-chose… Je vais juste te donner les règles sur les valeurs de n ℓ et mℓ (car pour s on a déjà vu c’est toujours +½ ou -½
- n lui va augmenter de 1 à chaque niveau
- ℓ va avoir de plus en plus de valeur différentes plus n sera grand donc la géométrie des orbitales va être de plus en plus complexe :
0 ≤ ℓ ≤ n - 1 - mℓ va avoir encore plus de valeur pour coller à tous les cas possibles d’orientation des géométries cheloues venant de ℓ :
-ℓ ≤ mℓ ≤ +ℓ
Expo de sculptures de ballons
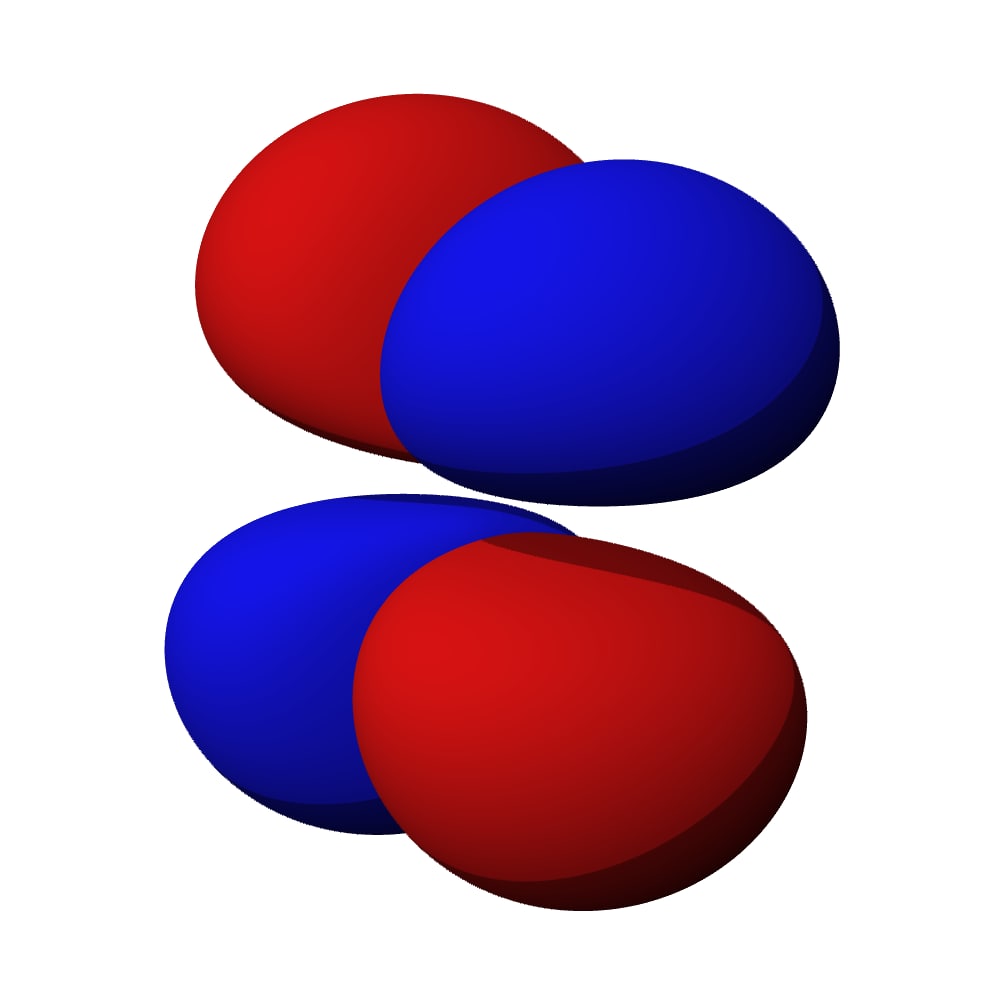
Et si vous vous demandez à quoi ça ressemble les orbitales d’après… attention bienvenue dans le monde des gros ballons de forme zarbi. Je vous présente donc 3px, 3py et 3pz :
Et maintenant 3dz², 3dxz, 3dyz, 3dxy, 3dx²-y² 👈 oui même les noms deviennent bizarres…
Vous vous demandez peut-être pourquoi depuis le début on a des couleurs rouge et bleue sur les orbitales… en fait tant qu’on a qu’un seul atome ça ne change pas grand-chose… mais quand tu formes des molécules avec 2 atomes, là ça change tout : le rouge ne se combine qu’avec le rouge et le bleu qu’avec le bleu alors que bleu + rouge = du vide (c’est-à-dire pas de liaison du tout). Bref, on s’en fout un peu ici…
Vous manquez encore de notations à la con ? No souci, vous pouvez faire confiance à nos amis chimistes : nos couches 1, 2, 3, etc., ils leur avaient aussi déjà donné des noms avant…
- La première couche (n=1) ils l’appelaient avant “couche K”
- La deuxième couche (n=2) ils l’appelaient avant “couche L”
- La 3ᵉ (n=3) c’était “couche M”
- etc.
donc K L M N O P Q… et cette notation est encore utilisée…
…et pourquoi on commence à la lettre K au fait ? Alors là c’est vraiment débile. Au début de la spectroscopie, on a surtout vu des raies correspondant à des sauts d’électrons dans des gros atomes (donc avec plein de couches) excités. Donc des électrons qui redescendent vers leur état de base genre vers la couche n=2 ou n=3. On a voulu nommer les couches avec des lettres de l’alphabet, mais on savait qu’en vrai il devait y avoir des couches plus basses… mais on ne savait pas combien 😅 alors on a commencé au milieu de l’alphabet : L.
Un peu après on s’est rendu compte qu’on avait eu raison : on a découvert des sauts jusqu’à une couche plus profonde qu’on a donc appelé K… sauf qu’on n’en a jamais trouvé de plus profonde. Et pour cause : couche K 👉 n=1 c’est la première couche !
Remerciements
Je tiens à remercier Cécile, Ophélie, Gui² et bien sûr Z. pour leurs questions, relectures, corrections, discussions et tout. Parce que, il faut bien avouer, cet article a été particulièrement velu, un genre de 😸Maine coon😸 de la physique !
Crédits photo
- Illustration de la couverture du livre Le Petit Prince - hors série musique chez Gallimard Jeunesse d’après un dessin d’Antoine de Saint-Exupéry
- Les représentations des orbitales atomiques sont issues de la page Wikipedia “orbitale atomique” et sont dans le domaine publique
- Tous les gifs issus de tenor.com selon leur conditions d’utilisation
Notes de bas de page
C’est désespérant de se rendre compte que le travail des chimistes en spectroscopie, en fait, c’est vraiment utile… c’est peut-être pas autant des branquignoles que je veux bien l’admettre #tellNoOne↩︎
En fait en faisant les calculs complets des orbitales atomiques de l’atome d’hydrogène, on a vraiment un moment où ces 3 valeurs apparaissent. On ne pourrait pas mettre 3 valeurs au hasard en vrai. Ça correspond réellement à une projection d’un moment angulaire sur un axe… bref, ici, on s’en tamponne. On n’est pas là pour les calculs.↩︎